- 肯亞的產科安全手術 (OSS) 項目由強生公司資助,迄今為止由 Jhpiego 作為牽頭組織與縣和國家衛生部以及專業協會合作實施。
- 為了支援推進實施,Proximie 和 Ariadne Labs 與 Jhpiego 建立了獨特的合作夥伴關係,將 Jhpiego 在安全產科手術方面的最佳實踐與 Proximie 的最先進技術平台結合,以利用多感官擴增實境工具。
- 產科安全手術項目與肯亞衛生部的領導層密切合作,旨在解決孕產婦健康領域的關鍵衛生系統挑戰,特別是剖腹產的安全和質素。
- 在全球,每天約有 810 名婦女死於與懷孕和分娩有關的可預防原因。此外,每天約有 6,700 名新生嬰兒死亡,佔所有 5 歲以下兒童死亡人數的 47%。與此同時,每年約有 200 萬嬰兒胎死腹中,其中 40% 以上發生在分娩期間。
- 50 億人(幾乎佔全球人口的四分三)無法獲得手術提供的挽救生命或避免殘疾的治療,而承擔這負擔的大部分人是生活在中低收入國家 (LMIC)。
- Proximie 的軟件將幫助虛擬培訓和指導手術團隊,幫助挽救母親和新生嬰兒的生命。
- 該項目目前正在馬庫埃尼縣推行。
倫敦2021年12月9日 /美通社/ -- Proximie 與約翰霍普金斯大學附屬機構 Jhpiego 合作,在肯亞開展一項安全手術項目,將他們獨特的軟件分層,讓世界各地的醫生能夠實時「參與」和指導同事。
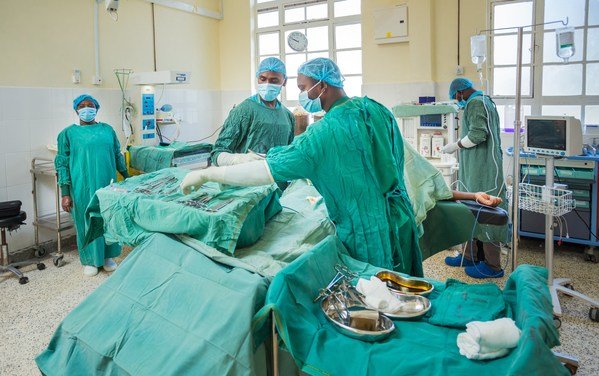 Physicians and nurses in the Jhpiego-led Obstetric Safe Surgery (OSS) Project in Kenya prepare for a C-section at Makueni County Referral Hospital, one of five hospitals participating in the skills-strengthening and mentorship program aimed at reducing maternal and newborn deaths.
Physicians and nurses in the Jhpiego-led Obstetric Safe Surgery (OSS) Project in Kenya prepare for a C-section at Makueni County Referral Hospital, one of five hospitals participating in the skills-strengthening and mentorship program aimed at reducing maternal and newborn deaths.Proximie 已向在 40 多個國家/地區開展工作的全球健康非牟利組織 Jhpiego 提供其技術,透過擴大和加強 Jhpiego 產科安全手術項目的學習和指導,改善婦女的產科手術護理,該項目目前在馬瓜尼縣的五家醫院進行。這個為期 22 個月的項目旨在支援肯亞政府透過提高剖腹產質素來減少孕產婦和新生嬰兒死亡以及產科相關傷害的承諾。在肯亞,71% 的設施孕產婦死亡與剖腹產有關,十分之九的孕產婦死亡與缺乏優質標準護理有關。
Jhpiego 領導的項目由強生公司資助,以衛生系統方法為基礎,利用當地專業知識建立護理網絡,以提供安全、及時的外科產科護理。 Proximie 平台為產科手術團隊提供增強和擴展學習的前景。
增強的產科安全手術項目之設計和評估由 Ariadne Labs 支援,其為布萊根婦女醫院和哈佛陳曾熙公共衛生學院的衛生系統創新聯合中心。
馬瓜尼縣 母嬰醫院醫療主管兼產科安全手術項目合作夥伴 Doris Mbithi 博士表示 Jhpiego-Proximie 聯盟將幫助外科醫生完善他們的技能並解決出現的問題。
她說:「有時事情發生在(手術)室,並不是所有的團隊成員都記得這個過程。通過錄影,我們可以找出差距並進行糾正。我很高興在晚上,我有可能在我的醫院提供遙距支援,或者透過遠程諮詢來幫助保留潛在的轉介病人。」
Jhpiego 安全外科全球總監 John Varallo 博士表示:「該合作夥伴關係可以增加迄今為止實現的影響,透過提供實時遠程外科諮詢,該項目具有真正改變遊戲規則的潛力,可以提高肯亞和 Jhpiego 工作的其他國家的外科護理安全和質素。與 Proximie 和 Ariadne Labs 的創新思想領袖合作,並繼續與肯亞政府和當地外科團隊密切合作,我們是產科安全手術工作的真正擁護者,有機會擴大迄今為止在手術安全和質素方面取得的進展。」
Proximie 行政總裁 Nadine Hachach-Haram 博士說,她創立 Proximie 是「基於分享知識可以加快學習和改善患者護理的精神」,而產科安全手術項目正體現了這點。
Hachach-Haram 說:「我們與肯亞當地外科團隊以及 Jhpiego 和 Ariadne Labs 的合作將有助普及重要的剖腹產手術技術和知識,否則這些技術和知識會因地理或時間而被擱下。Proximie 將在術前、術中和術後得到利用,以確保婦女及其嬰兒在關鍵時刻獲得優質的護理。我一直相信合作是推動醫療作出有意義變革的基石,產科安全手術項目不僅有助降低孕產婦和新生嬰兒死亡率,而且有望為其他人提供一個可遵循的藍圖。」
作為醫療創新和實施的領導者,Ariadne Labs 在設計和建設國內能力和專業知識以實施數碼創新方面擁有豐富的經驗,這些創新將用於為肯亞及其他地區關於可持續數碼健康的重要討論提供資訊。
首席研究員兼 Ariadne Labs 的 BetterBirth 項目主任 Katherine Semrau 博士及公共衛生碩士稱:「我們很高興與 Proximie 和 Jhpiego 合作,利用我們在公共衛生、前線臨床護理和以人為本的設計經驗,以提高女性及其新生嬰兒接受的手術護理質素及增強臨床醫生的體驗。無論是在波士頓、奈洛比或勒克瑙,Ariadne Labs 的目標是開發可擴展的系統級解決方案,為世界各地的人減少痛苦及挽救生命。我們期待支援這項工作的衡量和評估,以最終改進干預措施及其實施。」
編輯備註
您可以使用主題標籤 #ProjectSafeSurgery 以及在 Medium 雜誌 The Link 上跨社交媒體渠道關注該項目。
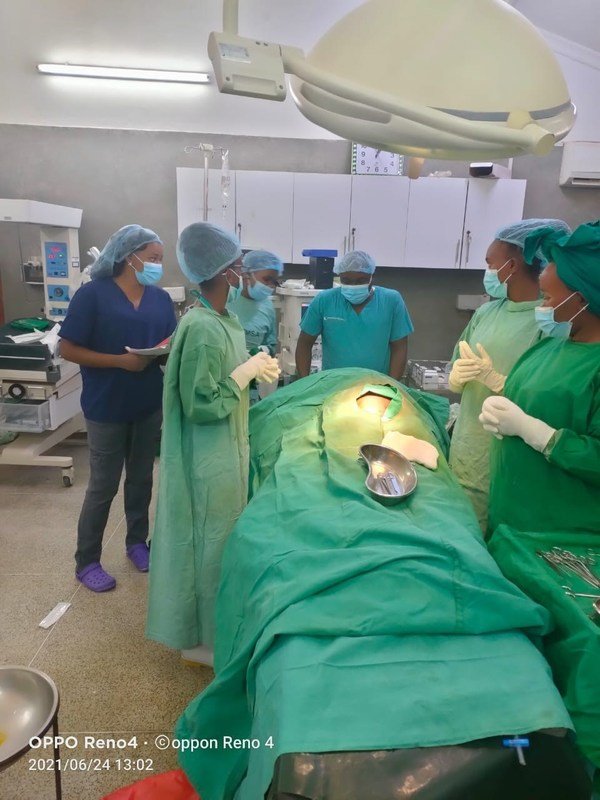 Mentorship is a key aspect of the Jhpiego-led Obstetric Safe Surgery (OSS) Project in Kenya. Sultan-Hamud Hospital is among the five health facilities participating in the project, that provides skills strengthening and sessions with expert mentors in an effort to reduce maternal and newborn deaths.
Mentorship is a key aspect of the Jhpiego-led Obstetric Safe Surgery (OSS) Project in Kenya. Sultan-Hamud Hospital is among the five health facilities participating in the project, that provides skills strengthening and sessions with expert mentors in an effort to reduce maternal and newborn deaths.












