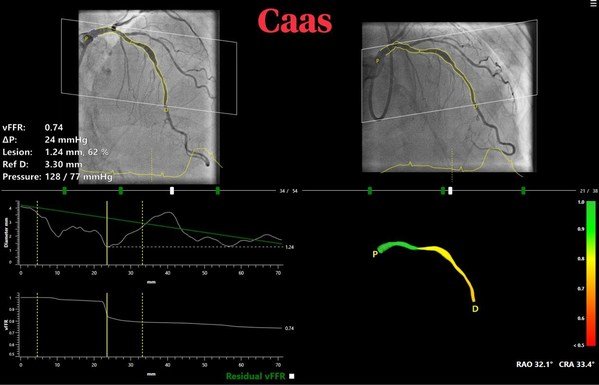
美國三藩市和中國蘇州2021年12月13日 /美通社/ -- 信達生物製藥集團(香港聯交所股票代碼:01801),一家致力於研發、生產和銷售用於治療腫瘤、代謝疾病、自身免疫等重大疾病的創新藥物的生物製藥公司,今日與馴鹿醫療,一家處於臨床階段、致力於細胞治療和抗體藥物開發和產業化的創新生物製藥公司,共同宣佈在2021年第63屆美國血液學會(ASH)年會上以口頭報告形式展示了共同開發的全人源自體B細胞成熟抗原(BMCA)嵌合抗原受體自體T細胞(CAR-T)療法的最新1/2期註冊性臨床研究結果(馴鹿醫療研發代號:CT103A,信達生物研發代號:IBI326)。口頭報告標題為:全人源B細胞成熟抗原特異性CAR-T細胞(CT103A)治療復發/難治性多發性骨髓瘤 (RRMM) 患者的1/2期臨床研究(摘要編號:547),報告人為華中科技大學同濟醫學院附屬同濟醫院李春蕊教授。
本次亮相ASH口頭報告的研究是一項正在中國開展的單臂、開放性、多中心臨床研究。研究主要入組了既往接受 ≥ 3線治療、漿細胞膜表達BCMA陽性、ECOG評分0-1分的RRMM患者,主要研究終點為總體緩解率(ORR),次要研究終點包括緩解持續時間(DOR)、無進展生存期(PFS)、總生存期(OS),以及安全性和耐受性、藥代動力學和藥效動力學特徵。本次會議報告的臨床資料截止日為2021年10月12日,納入共計79例接受II期推薦劑量(RP2D)1.0×106 CAR-T/Kg的受試者(包括9例參與研究者發起的早期探索性研究 [IIT]的受試者與70例參與註冊臨床研究 [NCT05066646] 的受試者)。
研究結果顯示,IBI326在人體內具有優異的安全性和有效性,並擁有長效持久的體記憶體續時間,有望成為復發難治性多發性骨髓瘤患者的突破性治療手段。
IBI326擁有優異且可控的安全性:79例受試者中,75例(94.9%)受試者發生細胞因數釋放綜合征(CRS),大部分為1~2級CRS,僅2例受試者為3級CRS(均發生在IIT研究階段,註冊臨床階段70例受試者未發生3級及以上的CRS),無4級/5級CRS。CRS發生的中位時間為回輸後第6.0天,CRS的中位持續時間為5.0天。僅1例受試者出現2級免疫效應細胞相關神經系統綜合征(ICANS),表現為一過性意識水準降低性,自行緩解。所有受試者的CRS和ICANS均得到緩解,其中20%受試者使用了托珠單抗治療,34.7%受試者使用了糖皮質激素治療。
IBI326擁有卓越且持久的有效性:79例受試者中,ORR為 94.9%,完全緩解/嚴格意義的完全緩解(CR/sCR)為58.2%,且隨著隨訪時間的延長,反應有加深的趨勢。回輸後6個月、9個月和12個月的PFS分別為78.0%、76.0%和71.0%。IBI326對合併髓外多發性骨髓瘤受試者亦展現了良好的療效,11例合併髓外多發性骨髓瘤受試者的ORR為100%,CR/sCR為72.7%。在79例受試者中,93.7%受試者在回輸後至少達到一次靈敏度為10-5的微小殘留病灶(MRD)陰性。
IBI326對於既往接受CAR-T治療後復發的受試者仍然有良好的療效:13例既往接受CAR-T治療的受試者的ORR為76.9%,61.5%達到非常好的部分緩解(VGPR)及以上,CR/sCR為46.2%。
IBI326在體內良好擴增且持久存續:外周血IBI326的CAR拷貝數中位元達峰時間為12天,中位峰值為92,000拷貝/ug DNA。回輸後隨訪12個月的18例受試者中,10例(55.6%)仍能檢測到IBI326。首例治療的受試者在回輸後34個月(1,013天)外周血仍可檢測到IBI326存續(4,040 拷貝/ug DNA),該受試者同時維持sCR狀態。IBI326回輸後外周血游離BCMA迅速下降並長期維持低於檢測下限。
IBI326具有較低的免疫原性:IBI326回輸後3個月內僅1.3%(1/79)受試者出現ADA陽性。中位隨訪7個月,僅12.7%(10/79)出現ADA陽性。
該項研究的組長單位 -- 中國醫學科學院血液病醫院的邱錄貴教授和華中科技大學同濟醫學院附屬同濟醫院的李春蕊教授均表示:「儘管既往靶向BCMA CAR-T 在RRMM中取得了良好的效果,然而高復發率依然是一個需要克服的難題。IBI326是一種全人源、靶向BCMA的CAR-T 產品,可降低宿主潛在的抗CAR免疫原性,減少復發。該項研究顯示了IBI326良好的療效與優異的安全性,同時具有良好的動力學及較低的免疫原性,這對於RRMM治療具有非常重要的價值,是未來研究的突破方向。」
信達生物高級副總裁周輝博士表示:「多發性骨髓瘤是血液系統常見高發的惡性腫瘤,復發耐藥在治療中不可避免,臨床亟需良好耐受性和深度持久回應的治療手段。很高興IBI326的I/II期臨床研究結果在本次ASH年會上進行口頭報告,顯示出了IBI326卓越持久的有效性和優異的安全性,也激勵我們進一步加快IBI326的臨床開發和註冊上市,給多發性骨髓瘤患者帶去新的治療希望。」
馴鹿醫療首席執行官兼首席醫學官汪文博士表示:「这是CT103A(驯鹿医疗研发代号)的臨床資料第二次以口頭報告的方式亮相ASH年會,有效性和安全性資料都令人振奮。本次數據納入來自11個中心的部分註冊臨床研究結果,值得一提的是,這是全球首個入組既往CAR-T治療失敗的受試者的註冊臨床試驗,針對這部分無藥可醫的治療需求,CT103A仍然表現出良好且持久的治療效果,更有力地體現了這款創新產品的實力。目前,公司還在將CT103A的臨床開發向前線治療、聯合用藥、適應症拓展、海外佈局四個維度推進,公司準備儘快提交新藥上市申請(NDA),期待這款產品早日上市,挽救更多患者的生命。」
關於多發性骨髓瘤(MM)
多發性骨髓瘤(MM)是最常見的血液癌症之一,是一種克隆性漿細胞異常增殖的惡性疾病。對於初治的多發性骨髓瘤患者,常用的一線治療藥物包括蛋白酶體抑制劑、免疫調節類藥物及烷化劑類藥物。對於大多數的患者,常用的一線治療可以使患者的病情穩定3-5年,但也有少部分患者在初治時表現為原發耐藥,病情不能得到有效控制。對於治療有效的大多數初治患者,在經過疾病穩定期後也會不可避免的進入復發、難治階段。因此,復發/難治多發性骨髓瘤患者仍存在未滿足的需求。在美國,MM約占所有癌症患者人數近2%,占癌症死亡患者人數的2%以上。根據弗若斯沙利文報告:
美國MM的新發病人數從2016年30,300 人增加至2020年32,300人,預計2025年將增加至37,800人。美國MM的患病人數從2016年132,200人增加到2020年144,900人,預計2025年將增加至162,300人。
中國MM的新發病人數由2016年18,900人增至 2020年21,100人,預計2025年將增長至24,500人。中國MM的患病率從2016年69,800 人增至2020年113,800人,預計2025年增長至182,200人。
關於IBI326(BCMA CAR-T)
IBI326(BCMA CAR-T)是由馴鹿醫療和信達生物製藥聯合開發的一種創新產品。本產品以慢病毒為基因載體轉染自體T細胞,CAR包含全人源scFv、CD8a 鉸鏈和跨膜、4-1BB共刺激和CD3ζ啟動結構域。基於嚴格的篩選,通過全面的體內外功能評價,IBI326 CAR-T產品具有強有力和快速的療效,並有突出的體內持久存續性。2021年2月,IBI326已獲得國家藥品監督管理局 (NMPA) 藥品審評中心(CDE)「突破性治療藥物」認定,用於治療復發/難治性多發性骨髓瘤。
關於信達生物
「始于信,達于行」,開發出老百姓用得起的高品質生物藥,是信達生物的理想和目標。信達生物成立於2011年,致力於開發、生產和銷售用於治療腫瘤、自身免疫、代謝疾病等重大疾病的創新藥物。2018年10月31日,信達生物製藥在香港聯合交易所有限公司主機板上市,股票代碼:01801。
自成立以來,公司憑藉創新成果和國際化的運營模式在眾多生物製藥公司中脫穎而出。建立起了一條包括26個新藥品種的產品鏈,覆蓋腫瘤、代謝疾病、自身免疫等多個疾病領域,其中7個品種入選國家「重大新藥創制」專項。公司已有6個產品(信迪利單抗注射液,商品名:達伯舒®,英文商標:TYVYT®;貝伐珠單抗生物類似藥,商品名:達攸同®,英文商標:BYVASDA®;阿達木單抗生物類似藥,商品名:蘇立信®,英文商標:SULINNO®;利妥昔單抗生物類似藥,商品名:達伯華®,英文商標:HALPRYZA®;pemigatinib口服抑制劑,商品名:達伯坦®,英文商標:PEMAZYRE®;奧雷巴替尼片,商品名:耐立克®)獲得批准上市,其中信迪利單抗在美國的上市申請(BLA)獲FDA受理,5個品種進入III期或關鍵性臨床研究,另外還有15個產品已進入臨床研究。
信達生物已組建了一支具有國際先進水準的高端生物藥開發、產業化人才團隊,包括眾多海歸專家,並與美國禮來製藥、Adimab、Incyte、MD Anderson 癌症中心和韓國Hanmi等國際合作方達成戰略合作。信達生物希望和大家一起努力,提高中國生物製藥產業的發展水準,以滿足百姓用藥可及性和人民對生命健康美好願望的追求。詳情請訪問公司網站:www.innoventbio.com或公司領英帳號www.linkedin.com/company/innovent-biologics/。
關於馴鹿醫療
馴鹿醫療是一家專注於細胞治療和抗體藥物開發和產業化的創新生物製藥公司。公司成立於2017年,已組建了一支在新藥研發、臨床研究以及商業化方面擁有豐富經驗的國際化管理團隊。公司以開發血液腫瘤細胞類藥物和抗體藥物為創新的基石,向實體瘤和自身免疫疾病拓展,擁有完整的從早期發現、註冊申報、臨床開發到商業化生產的全流程平臺能力及包括了全人源抗體發現平臺、高通量CAR-T藥物優選平臺、通用CAR技術平臺、生產技術平臺、臨床轉化研究平臺在內的多個技術平臺。現有10個在研品種處於不同研發階段,其中進展最為迅速的產品CT103A(全人源BCMA嵌合抗原受體自體T細胞注射液)已處於臨床開發後期階段,已於2021年2月被國家藥品監督管理局(NMPA)藥品審評中心(CDE)納入「突破性治療藥物」品種;公司自主研發的創新產品CT120(全人源CD19/CD22雙靶點CAR-T細胞注射液)已進入臨床研究階段,適應症分別為CD19/CD22陽性的復發/難治性B細胞非霍奇金淋巴瘤(B-NHL)和復發/難治性急性B淋巴細胞白血病(B-ALL)。
憑藉強執行力的管理團隊、豐富的產品管線、獨特的創新研發與商業模式,馴鹿醫療有志于成為業界有影響力的創新藥企,將真正解決臨床痛點、具有市場競爭力的創新藥物推向臨床直至市場,為受試者開闢新的治療道路,帶來新的希望。詳情請訪問公司網站:www.iasobio.com或領英主頁:IASO Biotherapeutics (馴鹿醫療)。
聲明:
1. 該適應症為研究中的藥品用法,尚未在中國獲批;
2. 信達不推薦任何未獲批的藥品/適應症使用;
3. 僅供醫療衛生專業人士交流使用。
前瞻性聲明
本新聞稿所發佈的資訊中可能會包含某些前瞻性表述。這些表述本質上具有相當風險和不確定性。在使用「預期」、「相信」、「預測」、「期望」、「打算」及其他類似詞語進行表述時,凡與本公司有關的,目的均是要指明其屬前瞻性表述。本公司並無義務不斷地更新這些預測性陳述。
這些前瞻性表述乃基於本公司管理層在做出表述時對未來事務的現有看法、假設、期望、估計、預測和理解。這些表述並非對未來發展的保證,會受到風險、不確性及其他因素的影響,有些乃超出本公司的控制範圍,難以預計。因此,受我們的業務、競爭環境、政治、經濟、法律和社會情況的未來變化及發展的影響,實際結果可能會與前瞻性表述所含資料有較大差別。