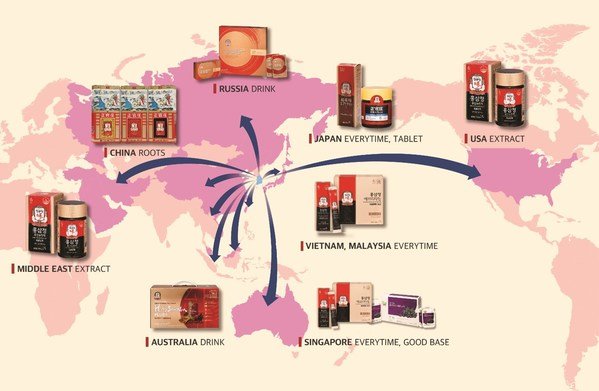
-亞洲喜方便vs.美國和中東喜自然,由於對健康產品興趣高,越來越多年輕人青睞紅參
韓國首爾2022年1月24日 /美通社/ -- 韓國人參公社(Korea Ginseng Corp.,簡稱KGC)推出「World Map of Red Ginseng」(世界紅參地圖),根據去年正官莊 (CheongKwanJang) 紅參的海外市場銷售情況,按國家評選暢銷品,恭賀2022新年。
Korea Ginseng Corp.
"Everytime"是一種易於攜帶和食用的條狀包裝紅參產品,在六個亞洲地區(包括日本)銷售排名第一。
作為韓流食品的起源,紅參在慶祝新年假期的亞洲已經成為一種很受歡迎的禮品,海外市場的需求也在增加。由於年輕消費者有所增加,全世界越來越重視健康,加上韓劇的影響也提高了人們對紅參的認識,從而推動了市場發展。電商發展推動銷售渠道多元化加上產品的升級換代也產生了積極影響。
韓國領先的紅參製造公司KGC的海外出口表現也很出色。與新冠肺炎爆發前的19年銷售額相比,20年銷售額增長了4.8%,21年第三季度的累計銷售額也較19年銷售額增長了約20%。
<「Tinghao Red Ginseng」銷售額最高的是中國大陸,最受歡迎的產品為「Korean Red Ginseng Roots」>
中國大陸在海外紅參市場中所佔份額最大。中國大陸歷來將韓國產紅參稱為「高麗參」,並公認其為一種高端藥品。
在中國大陸銷售的「Korean Red Ginseng Roots」因品質得到了認可,並已成為消費者為健康和送禮而購買的首選品牌。
由於韓國農曆新年文化與中國大陸類似,中國大陸1月和2月的銷售額占年銷售額的20%以上。最暢銷的產品「Korean Red Ginseng Roots」春節期間的銷量也超過了20%。基於孝道文化,該產品經常被作為送給老年人的禮物。
在台灣和香港地區,人們以前普遍認為「它是一種適合老年人的產品,效果良好,但價格昂貴」,但據分析,條狀包裝紅參產品「Everytime」 推出之後,人們對紅參的印象已經徹底改變了。
在台灣地區,「Everytime」以38%的市場份額排名第一,在將根參導向市場轉變為產品導向市場方面發揮了重要作用。在保持紅參優良功效的同時,它增加了便攜性和方便性,以30多歲的辦公人員為銷售目標,因此取得了成功。通過這些努力,2020年台灣地區的銷售額較2017年增長了259%,實現了顯著增長。農曆新年期間,該地區的銷售額占比也很高,佔其年銷售額的19-20%。
在香港,人們也十分喜愛紅參。很久以前,香港地區就以其人參交易中心而聞名,從韓國進口紅參,售往世界各地。香港地區對傳統藥品的認識和接受度很高,因此形成了一個比韓國醫藥市場更大的中醫藥市場。
在香港,「Everytime」的銷量也排名第一。人們認識到它在韓國是一種熱銷品,方便食用,而且似乎所有年齡段的人購買它都是為了自己食用。排名其次的分別是含有紅參的紅石榴飲和野櫻莓飲產品。
<韓流推動韓國紅參在東南亞受熱捧,尤其是新加坡和越南增長最強勁>
在紅參出口的國家中,近年來增長較快的國家有新加坡、越南、馬來西亞等東南亞地區。由於韓國流行文化的發展,各種韓流產品開始風靡,韓國紅參產品也深受當地人歡迎。
在新加坡和馬來西亞以華人消費者為主,他們對人參有所瞭解。
新加坡的「Everytime」銷量比例也最高。這個亞洲國家不同民族的人們生活在一起,東西方文化在這裡交叉碰撞,人們樂意接納新事物。在馬來西亞,華人消費者也是主要的消費群體,銷售主要發生在最重要的節日新年(1月1日)。「Everytime」也在本地銷售中位居榜首。這是因為韓劇非常受歡迎,而經常作為植入式廣告出現的「Everytime」在當地越來越受歡迎。
越南人非常喜歡紅參,認為它是最豪華、最珍貴的健康禮物。在越南,「Everytime」銷量最高。由於年輕人比例很高,他們更喜歡容易攜帶和食用的產品。在越南最大的假期TET(農曆新年第一天),它作為一種高質量的健康禮物,很受當地人歡迎,在越南線上市場人參產品中排名第一。含有100%紅參濃縮液的「Red Ginseng Tablet」作為高端禮物很受歡迎,位居第二。
日本消費者非常重視產品質量,在購買少量體驗後,只有在認為合適時,才會表現出定期購買的傾向。
條狀包裝紅參產品「Everytime」在日本也很受歡迎。過去,紅參片賣得很多,但最近,經常在韓劇裡看到條狀包裝紅參的年輕一代越來越喜歡這種產品。
<在亞洲以外最大的市場美國,「Red Ginseng Extract」以其大容量和出色功效在美國排名第一>
除了亞洲國家,美國是世界上最大的人參產品市場和人參出口國。正官莊正努力發展當地市場,在美國各地開設了30多家門店。
去年9月份,正官莊在紐約曼哈頓開設了一家體驗店Ginseng Museum Cafe。在這裡,一些不熟悉紅參的外國人可以體驗和瞭解韓國人參的歷史和功效。
雖然大多數進店的都是亞洲人,但是非亞洲人也絡繹不絕的到來。特別是,人們對店裡每天製作的「Red Ginseng Roots Liquid」反響很好。它的味道不像預期的那麼苦,而且它內部製作的事實值得高度讚賞。
在當地市場最受歡迎的產品是一種紅參濃縮物「Red Ginseng Extract」。與美國廣大的領土相比,店舖並不多,所以消費者更喜歡那些購買後可以長時間食用的產品。「Red Ginseng Extract」的容量為240克,可食用約3個月,具有豐富的紅參味道和香氣,因此也被稱為生活在美國的韓國中年人的必備品。
<澳大利亞和俄羅斯的紅參飲品「Hong Sam Won」以及中東的 「Red Ginseng Extract」>
在澳大利亞,飲品「Hong Sam Won」位居銷量榜首。通過進入Costco這樣的大型分銷店,擴大了體驗規模,味道很溫和,也可以讓當地人提高對紅參的熟悉程度。「Red Ginseng Extract」銷量第二。
「Hong Sam Won」也是俄羅斯最暢銷的產品。它的味道類似於傳統的俄羅斯飲料(kvass),因對健康有益,很受當地人的歡迎,尤其是40歲以上女性。
在中東地區,最受歡迎的產品是濃縮形式的「Red Ginseng Extract」。
<通過產品開發和電商實現銷售渠道多元化的出色結果>
在「紅參世界地圖」中,不同國家食用紅參的文化也不同,他們喜歡的產品類型也各不相同。雖然紅參在海外有著悠久的歷史,被稱為韓國食品的先驅,但由於各國對保健食品的諸多規定,紅參的發展仍存在困難。近年來,各種紅參產品得到開發,隨著產品註冊和市場開發的穩步進行,取得了切實成果。
特別是,隨著新冠疫情後網購更加活躍,紅參的銷售顯著增長,尤其是電商平台。KGC還將其海外子公司的所有主頁改為網上購物中心,並將正官莊產品的銷售擴大到天貓、亞馬遜、Lazada和Shopee等大型海外電商網站。
KGC 全球CIC總監Kim Nae-soo表示:「紅參是韓國的文化驕傲,也是我們祖先傳承下來的重要遺產,」他補充說:「我們將盡最大努力,以作為行業代表的責任感,向世界推廣我們的紅參。」