首次公佈用於治療華氏巨球蛋白血症(WM)的3期臨床試驗中攜帶MYD88野生基因型患者亞組的初步數據;公佈用於治療WM的1/2期臨床試驗更新數據;以及公佈澤布替尼治療B細胞惡性腫瘤的安全性數據匯總分析
公司將于6月20日(星期四)美國東部時間上午八點就2019年年中臨床數據更新舉辦投資者電話會議和網絡直播
美國麻省劍橋和中國北京 2019年6月14日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼:06160),是一家處於商業階段的生物醫藥公司,專注于用於癌症治療的創新型分子靶向和腫瘤免疫藥物的開發和商業化。百濟神州今天在第24屆歐洲血液學協會(EHA)年會上首次公佈了其在研BTK抑制劑澤布替尼用於治療華氏巨球蛋白血症(WM)患者的一項隨機、開放性的全球3期ASPEN臨床研究的數據。海報展示包括了非隨機、探索性的攜帶MYD88野生基因型的WM患者亞組臨床數據。此外,公司還在EHA年會上以海報的形式公佈了正在開展的澤布替尼用於治療WM患者的一項1/2期臨床研究的更新結果,以及在六項正在開展的澤布替尼作為單藥治療B細胞惡性腫 瘤臨床研究中進行的安全性數據匯總分析。本次大會于6月13日至16日在荷蘭阿姆斯特丹舉行。
百濟神州血液學首席醫學官黃蔚娟醫學博士表示:「我們很高興能在EHA年會上公佈正在開展的澤布替尼臨床研究的新數據,包括首次公佈ASPEN3期臨床試驗中攜帶MYD88野生基因型WM患者的非隨機亞組的初步結果。在這個患者群體中,通常緩解率較低而且預後效果並不理想。我們也從中看到對一款能夠對BTK靶點持續抑制並降低脫靶效應的高效、高選擇性的BTK抑制劑的現實存在的需求。令人振奮的是,這些數據與早先臨床試驗結果相一致,總緩解率達到 81%,主要緩解率為54%(包括達到部分緩解或更好)包括23%的非常好的部分緩解(VGPR)。我們會繼續關注這些患者以進一步評估治療效果。這項臨床研究的完整結果將在今年下半年的一場醫學會議上公佈。」
黃蔚娟醫學博士補充道:「此外,關於一項全球1/2期澤布替尼用於治療W M患者的臨床試驗,在隨訪時間增加的情況下,我們看到了頗高的完全緩解率和非常好的部分緩解(42% ),也直接反映了緩解的持久。另外,澤布替尼的安全數據匯總也進一步證明了其作為一款高選擇性的BTK抑制劑在B細胞惡性腫瘤患者中的耐受性。我們相信這些數據為澤布替尼成為治療全球B細胞惡性腫瘤患者的一項潛在、有意義的治療方案提供了強有力的支援。」
澤布替尼用於治療攜帶MYD88野生基因型WM患者的主要緩解
摘要編號:PF487
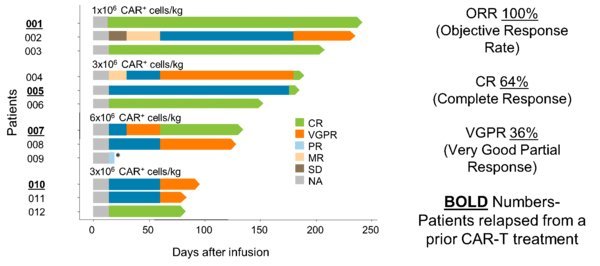
ASPEN是一項隨機、開放性、 多中心的澤布替尼對比伊布替尼用於治療WM患者的3期臨床試驗(clinicaltrials.gov登記號:NCT03053440),26位在入組檢測時集中確認攜帶MYD88野生基因型 的WM患者入組此項試驗。這些患者入組非隨機的亞組,並接受劑量為每次160mg、每日兩次口服給藥(BID)的澤布替尼給藥。基於修改後的IWWM-6標準對緩解進行評估,試驗終點為完全緩解(CR)和非常好的部分緩解(VRPR)的合併率、總緩解率(ORR)、主要緩解率(MRR)以及安全性。
這項探索性分析包括五位初治(TN)WM患者以及21位復發/難治性(R/R)WM患者。
截至2019年2月28日,中位隨訪時間為12.2個月(2.3-21.7),17位患者仍在接受治療。 結果包括:
- ORR為80.8%;MRR(部分緩解或更好)為53.8%;VGPR為23.1%;一位患者達到了IgM標準評估的完全緩解,IgM水準正常並且免疫固定呈陰性;
- 達到首次主要緩解(部分緩解或更好)的中位時間為2.9個月;
- 中位無進展生存期(PFS)和總生存期(OS)尚未達到;
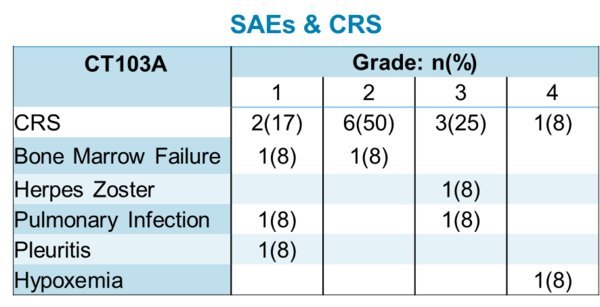
- 澤布替尼總體耐受性與先前報導數據的一致。由於不良事件(AE)導致的試驗治療中斷在7.7%的患者(n=2)中出現,主要原因為疾病進展。
- 最常報導的AE(在多於15%患者中出現)為腹瀉(19%)、高血壓(19%)、挫傷(15%)、便秘(15%)、肌肉痙攣(15%)、肺炎(15%)以及上呼吸道感染(15%);
- 沒有致死AE或心房顫動/撲動事件被報導;以及
- 在通常與BTK抑制劑相關的AE中,九位患者觀察到出血(34.6%)、五位患者觀察到高血壓(19.2%)、四位患者觀察到有三或四級的血細胞減少(15.4%)、三位患者觀察到三或四級的感染(11.5%)、 三位患者出現繼發性惡性腫瘤(11.5%)。 兩位患者出現重大出血(7.7%)。
雅典大學校長、臨床治療系主席、血液學和醫學腫瘤學教授兼本次海報第一作者MeletiosA. Dimopoulos醫學博士評論道:「澤布替尼是一款高效力、高選擇性的BTK抑制劑,其生物可利用度可觀,並在ASPEN3期臨床試驗的探索性患者亞組中總體耐受。 對於攜帶MYD88野生基因型的患者而言,我們很高興能看到這次公佈的數據支援先前1/2 期臨床研究的結果。」
全球1/2期臨床試驗更新數據概述
摘要編號:PF481
這項開放性的澤布替尼作為單藥治療B細胞惡性腫瘤患者的全球1/2期臨床試驗(clinicaltrials.gov登記號:NCT02343120)包括了一個WM患者亞組。此項試驗正在澳大利亞、紐西蘭、美國、義大利、英國和韓國開展。 截至2018年9月16日,77位之前沒有接受過BTK治療的WM患者(24 TN; 53 R/R)入組了此項試驗;中位隨訪時間位23.9個月(4.4-45.7)。根據修改後的IWWM-6標準,73位WM患者(24 TN;49 R/R)符合療效評估條件。截至數據截點,61位患者仍在接受研究治療。更新結果包括:
- 基於獨立評審委員會(IRC)評估的ORR為92%(67/73),包括82%的MRR(60/73)以及CR/VGPR率為42%(31/73);
- 12個月PFS估計值為90%;24個月PFS估計值為81%;
- 澤布替尼總體耐受性與先前報導的用於治療多種B細胞惡性腫瘤患者的數據一致。多數AE為一級或二級,其中最常報導的AE為上呼吸道感染(46%)、挫傷(30%)、咳嗽(20%)、頭痛(18%)以及腹瀉(17%);
- 三至四級AE在51.9%的患者中出現,其中出現在多於三位患者中的 任何歸因的三至四級AE包括中性白細胞增多(10%) 、貧血(7.8%)、基底細胞癌(5%)以及高血壓(5%);以及
- 在中位隨訪為24個月的情況下,AE導致的試驗治療中斷出現在10.4%的患者中,包括五例死亡事件。
悉尼Concord Repatriation總醫院血液學臨床研究主任、高級專家兼本次海報第一作者J udith Trotman,內外全科醫學士、澳大利亞皇家內科醫師學會會員、澳洲皇家病理科醫學院榮授院士表示:「目前澤布替尼 的1/2期臨床研究已經開展了超過四年,隨著研究的不斷深入, 我們也為其在先前從未接受BTK抑制劑治療的WM患者中展現的耐受性和療效感到興奮。」
澤布替尼作為單藥治療 B 細胞惡性腫瘤的安全性數據匯總分析
摘要編號:PS1159
六項正在開展的澤布替尼作為單藥的1期和2期臨床試驗的安全性數據被包括在這項匯總分析中,共計有682位非霍奇金淋巴瘤(NHL)患者、WM患者以及慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/SLL)患者。 大部分患者有R/R疾病;幾乎所有患者都接受了劑量為每次320mg、每日一次,或每次 160mg、每日兩次口服給藥(BID)的澤布替尼治療;接受澤布替尼治療的中位時間為13.4個月(0.1-49.7)。
此項分析包括對AE出現頻率和嚴重性、與BTK抑制劑相關的AE(AESIs)、導致死亡的AE、劑量遞減或治療中斷的評估。
97%的患者報導了至少一起AE,其中大部分為一級或二級。 無論嚴重性,最常見的AE為上呼吸道感染(32.4%)、中性粒細胞計數下降 (25.2%)、腹瀉(19.4%)、咳嗽(19.1%)、挫傷(18.6%)以及皮疹(18%)。 最常見的三級及以上的AE包括中性粒細胞計數下降(14.4%)、 貧血(7.6%)、中性白細胞增多(6.6%)、肺炎(4.5% )、血小板計數減少(4.3%)以及肺部感染(4.1%)。 嚴重不良事件(SAE)在36%的患者中被報導,主要 為包括肺炎和肺部感染在內的感染性併發症。
通常與BTK抑制劑相關的不良事件並不常見,包括心房顫動/撲動(1.9%)、大出血(2.5%)和三級以上的高血壓(3.4%)。由於AE導致的治療中斷也不常見,總共有9.1%的患者,其中3.5%與治療相關。
澳大利亞 St. Vincent 醫院血液學主任,Peter MacCallum 癌症中心低度淋巴瘤和慢性淋巴細胞白血病血液組組長兼本次海報第一作者 Constantine S. Tam醫學博士說道:「澤布替尼總體耐受,由與治療相關的不良事件導致的治療中斷不足百分之五。 從這組數據中也證明了澤布替尼對BTK完全和持續的抑制帶來較低的與安全性相關的治療失敗率。」
2019 年年中臨床數據更新的投資者電話會議和網絡直播信息:
百濟神州將于 2019 年 6 月 20 日(星期四)美國東部時間上午八點舉辦電話會議和網絡直播。投資者和分析師可以通過撥打以下電話號碼收聽電話會議:
美國免費電話:+1 (844) 461-9930
美國付費電話:+1 (478) 219-0535
香港免費電話:+852 800 279 19250
中國大陸免費電話:+86 800 914 686
會議室 ID:1790069
本次電話會議將在百濟神州官方網站內的投資者關係板塊(http://ir.beigene.com/ 或http://hkexir.beigene.com)進行網絡直播。直播重播記錄于會議結束兩個小時之後可供查看,並于 90 天內作為存檔以供查看。
關於澤布替尼
澤布替尼是一款在研的布魯頓氏酪氨酸激酶(BTK)小分子抑制劑,目前正在全球進行廣泛的關鍵性臨床試驗專案,作為單藥和與其他療法進行聯合用藥治療多種淋巴瘤。
百濟神州針對澤布替尼開展廣泛的臨床研究包括一項已完成患者入組的針對華氏巨球蛋白血症(WM)患者對比伊布替尼的全球 3 期臨床研究;一項針對初治慢性淋巴細胞白血病(CLL)/ 小淋巴細胞淋巴瘤(SLL)患者的全球 3 期臨床研究;一項與 GAZYVA®(奧比妥珠單抗)聯合用藥治療復發/難治性(R/R)濾泡性淋巴瘤的全球關鍵性 2 期臨床研究;一項針對 R/R CLL/ SLL 患者對比伊布替尼的全球 3 期臨床研究; 一項全球 1 期臨床研究。 在中國,百濟神州已經完成了兩項澤布替尼的關鍵性 2 期臨床試驗,分別用於治療 MCL 患者和 CLL/SLL 患者;還完成了澤布替尼用於治療 WM 患者的關鍵 2期 臨床試驗患者入組。
美國食品藥品監督管理局(FDA)已授予澤布替尼用於治療 WM 患者的快速通道資格(Fast Track designation)以及用於治療先前至少接受過一種治療的成年 MCL 患者的突破性療法認定(Breakthrough Therapy designation)。 中國國家藥品監督管理局(NMPA)藥品審評中心(CDE)正在對澤布替尼用於治療 R/RMCL 和 R/R CLL/SLL 的新藥上市申請(NDA)進行審評,兩者均被納入優先審評。
關於百濟神州
百濟神州是一家全球性的、商業階段的、以研發為基礎的生物科技公司,專注于分子靶向和免疫腫瘤療法的研發。 百濟神州目前在中國大陸、美國、澳大利亞和瑞士擁有約為2,400 名員工,在研產品線包括新型口服小分子類和單克隆抗體類抗癌藥物。 百濟神州目前也正在打造抗癌治療的藥物組合方案,旨在為癌症患者的生活帶來持續、深遠的影響。 在新基公司的授權下,百濟神州在華銷售 ABRAXANE®注射用紫杉醇(納米白蛋白顆粒結合型)、瑞複美®(來那度胺)和維達莎®(注射用阿紮胞苷)。 [1]
前瞻性聲明
根據《1995 年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律要求,該新聞稿包含前瞻性聲明,包括有關百濟神州對澤布替尼相關的進展計畫、預期的臨床開發計畫、藥政註冊里程碑及澤布替尼的商業化等。 由於各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。 這些因素包括了以下事項的風險:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支援進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時程表和進展以及產品上市審批 ;百濟神州的上市產品及藥物候選物(如能獲批)獲得商業成功的能力;百濟神州 對其技術和藥物智慧財產權保護獲得和維護的能力;百濟神州依賴協力廠商進行藥物開發、生產和其他服務的情況 ;百濟神州有限的營運歷史和獲得進一步的營運資金以完成候選藥物開發和商業化的能力;以及百濟神州在最近季度報告的 10-Q表格中「風險因素」章節裡更 全面討論的各類風險;以及百濟神州向美國證券交易委員會期後呈報中關於潛在風險、 不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及于新聞稿發佈之日,除非法律要求,百濟神州並無責任更新該些信息。
[1] ABRAXANE®, REVLIMID®, and VIDAZA® are registered trademarks of Celgene Corporation.