-基准醫療肺癌早診篇-基於血液的cfDNA甲基化模型PulmoSeek可精准判斷肺結節良惡性,助力實現肺癌早診早治
廣州2021年4月26日 /美通社/ -- 近日,基准醫療范建兵教授團隊與廣州醫科大學附屬第一醫院何建行教授/梁文華教授團隊、中山大學附屬第一醫院程超教授團隊、中南大學湘雅二醫院喻風雷教授團隊等14家參研中心在國際知名學術期刊《The Journal of Clinical Investigation》(影響因子:11.864)發表了標題為Accurate diagnosis of pulmonary nodules using a non-invasive DNA methylation test的多中心臨床研究論文。
2020年12月15日,世界衛生組織國際癌症研究機構(IARC)發布了2020年全球最新癌症數據,統計了全球185個國家36種癌症類型的最新發病率、死亡率情況,以及癌症發展趨勢。數據顯示,2020年全球新發癌症1930萬例,死亡近1000萬例;每5人中就有1人將在其一生中患癌症;每8名男性、每11名女性中就有1人將因癌症而死亡,其中,肺癌仍是導致癌症死亡的首要原因,約占癌症總死亡人數的18%。
研究發現,肺癌的預後與診斷階段高度相關,5年總生存率從IA期的85%顯著下降到IV期的6%。這使得肺癌早篩早診成為一種挽救生命和節省醫療成本的最有利策略。
目前,對肺結節患者的臨床管理依賴於重復的LDCT/CT掃描或侵入性檢查,但這些方式易引起誤判及過度診療,現階段迫切需要一種准確的非侵入性檢查來識別良惡性結節從而減少非必要的侵入性檢查。
本項研究結果表明,基於血液的cfDNA甲基化標志物分類模型PulmoSeek可作為更好的檢測手段來實現肺結節良惡性分類,顯著提升肺結節診斷准確率,並為臨床診療提供更有效決策指導,助力肺癌早發現早治療。
作為肺癌早診的一個突破性進展,基准醫療已成功將甲基化檢測模型PulmoSeek升級為PulmoSeek Plus。PulmoSeek Plus是全球首個通過聯合外周血中肺癌特異性DNA甲基化位點的甲基化水平和肺部結節CT影像學AI分析,經機器學習構建出的聯合診斷模型。我們將在近期公布PulmoSeek Plus的資訊,敬請留意。
以下為本項研究具體內容分享:
本項目基於389例5-30mm肺結節陽性患者血漿樣品,通過靶向DNA甲基化測序,開發了PulmoSeek肺結節良惡性診斷模型,並在140例血漿樣品集中進行了獨立驗證;與此同時,本研究還在不同病理分期、不同結節大小及不同結節類型亞組中測試了該模型的診斷性能。
1、研究工作流程
在該項14家中心參與的前瞻性采樣、回顧性盲法評估臨床研究(prospective-specimen collection and retrospective-blinded-evaluation,PRoBE)中,合計入組585例患者,因cfDNA提取量不足(<5ng)排除30例,因測序QC不合格排除26例。利用309例血漿樣本作為訓練集,構建了PulmoSeek診斷模型,並在80例血漿樣本的測試集中初步評估了該模型的診斷性能;之後,又在140例血漿樣本的獨立驗證集中對該模型進一步評估。本研究重點考察了該模型對於直徑為6-20mm且臨床上判別難度較大的結節的診斷性能。最後,將PulmoSeek模型與其他臨床常用的檢測手段進行了比較(Figure 1)。
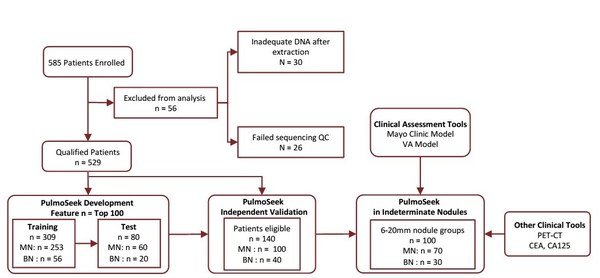
Figure1. Study flow of participants in the study.
2、PulmoSeek與Mayo Clinic/VA模型在5-30mm結節診斷中的性能比較
從ROC曲線可以看出PulmoSeek良好的分類性能(Figure 2):
(A)在測試集中,PulmoSeek模型ROC曲線下面積(AUC)為0.83;在獨立驗證集中,AUC為0.84。
(B)在獨立驗證集中,Mayo Clinic模型的AUC為0.59,而Veteran's Affairs(VA)模型的AUC為0.54。
(C)PulmoSeek在測試集(包含20例良性結節和60例惡性結節)的混淆矩陣及模型預測分數的分布。
(D)PulmoSeek在獨立驗證集(包含40例良性結節和100例惡性結節)的混淆矩陣及模型預測分數的分布。
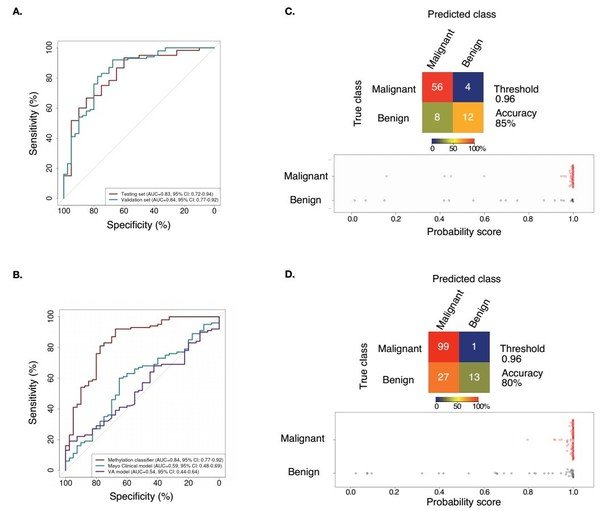
Figure2. PulmoSeek performance compared to Mayo Clinic/VA model in all nodule sizes.
3、PulmoSeek在早期肺癌中的表現
以下數據基於獨立驗證集計算得出(Figure3):
(A)PulmoSeek在早期癌症中的敏感性:0期為100%(n=2),IA期為94.1%(n=85),1B期為100%(n =5)。
(B)PulmoSeek在IA期不同亞分期的敏感性:IA1期為86.4%(n=22),IA2期為95.0%(n=40),1A3期為100% (n=23)。
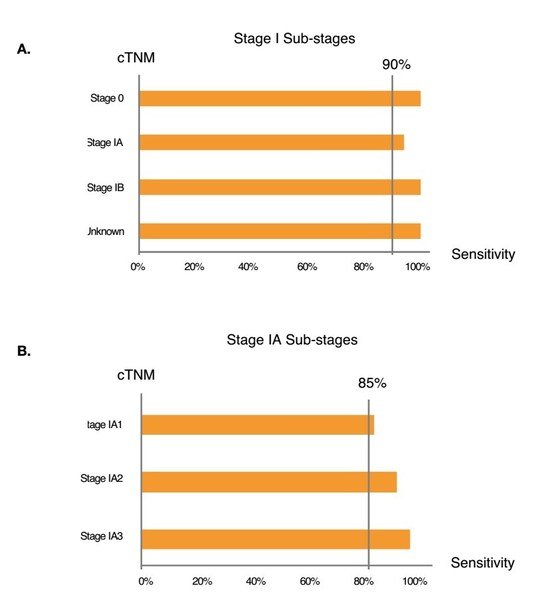
Figure3. PulmoSeek performance in early-stage lung cancer.
4、PulmoSeek與Mayo Clinic/VA模型在6-20mm結節中的性能比較(Figure 4)
(A)在測試集中,PulmoSeek模型AUC為0.76;在獨立驗證集中,PulmoSeek模型AUC為0.84。
(B)在獨立驗證集中,Mayo Clinic模型的AUC為0.60,VA模型的AUC為0.51。
(C)PulmoSeek在測試集(包含14例良性結節和43例惡性結節)的混淆矩陣以及模型預測分數的分布。
(D)PulmoSeek在獨立驗證集(包含30例良性結節和73例惡性結節)的混淆矩陣以及模型預測分數的分布。
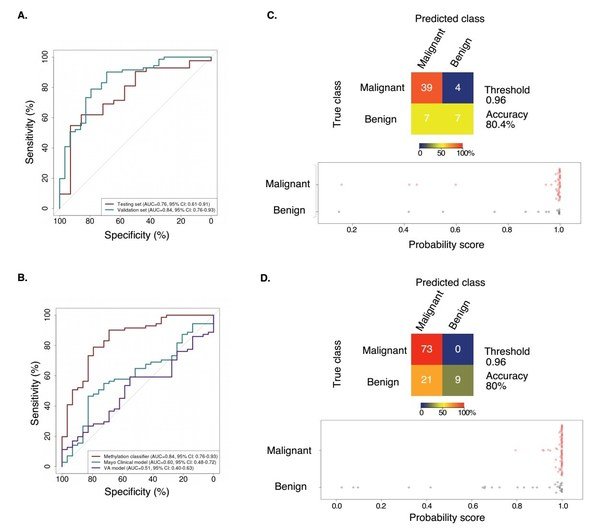
Figure 4. PulmoSeek performance compared to Mayo Clinic/VA model in 6-20mm nodule sizes.
5、PulmoSeek與PET-CT在不同類型結節中的性能比較
該圖(Figure 5)顯示了獨立驗證集中包含PET-CT診斷記錄的每個患者分別基於PulmoSeek(盒形)和PET-CT(菱形)的診斷結果。綠色表示樣品診斷正確,紅色表示不正確。PulmoSeek正確識別了實性結節亞型中的8/10例,部分實性結節亞型中的9/11例,磨玻璃結節亞型中的5/5例。PET-CT正確地識別了實性結節亞型中的6/10例,部分實性結節亞型中的7/11例,磨玻璃結節亞型中的0/5例。
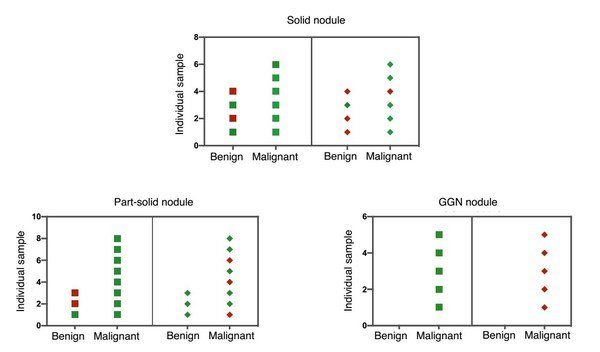
Figure 5. PulmoSeek performance in different nodule types and comparison to PET-CT.
本研究通過將深度學習以及傳統機器學習算法相結合,成功開發出一個具有100個甲基化標志物的模型PulmoSeek,並對其進行了多維度驗證:該模型在140個獨立驗證樣本上的ROC-AUC為0.843,准確率為0.800。該模型在多個方面的評價中均表現出優異的綜合診斷性能:1)在6-20mm大小的結節亞組(N=100)中,當發病率為10%時,模型靈敏度為1.000,NPV為1.000;2)在I期肺癌樣本中(N=90),敏感性為0.971;3)在不同的結節類型中模型表現同樣穩定:當發病率為10%時,對於實性結節亞型(N = 78),靈敏度為1.000,矯正後NPV為1.000;對於部分實性結節亞型(N=75),靈敏度為0.947,矯正後NPV為0.983;對於純磨玻璃結節(N=67),靈敏度為0.964,矯正後NPV為0.989。通過比較分析發現,在區分惡性肺結節與良性肺結節方面,PulmoSeek模型優於PET-CT及兩種臨床常用的肺結節評估模型(Mayo Clinic和Veterans Affairs)。
原文鏈接:https://www.jci.org/articles/view/145973
特別鳴謝14家參研中心及團隊:(排名不分先後)
廣州醫科大學附屬第一醫院,何建行教授/梁文華教授團隊;
中山大學附屬第一醫院,程超教授團隊;
中南大學湘雅二醫院,喻風雷教授團隊;
中南大學湘雅醫院,張春芳教授團隊;
四川大學華西醫院,劉倫旭教授團隊;
山東大學齊魯醫院,田輝教授團隊;
南方醫科大學南方醫院,蔡開燦教授團隊;
南華大學附屬第二醫院,劉翔教授團隊;
深圳市人民醫院,王正教授團隊;
安徽省胸科醫院,徐寧教授團隊;
哈爾濱醫科大學附屬第四醫院,崔鍵教授團隊;
江蘇省人民醫院,陳亮教授團隊;
北京腫瘤醫院,楊躍教授團隊;
首都醫科大學宣武醫院,支修益教授團隊。
關於基准醫療AnchorDx
引領精准醫療,造福千家萬戶。
基准醫療成立於2015年,由基因技術領域的世界級團隊領軍,是一家國際領先的采用甲基化高通量測序進行癌症早篩早診產品開發的公司。
基准醫療是國內首家將DNA甲基化高通量測序技術用於腫瘤診斷的公司,並自主打造了國內最大早期癌症甲基化數據庫。同時,基准醫療還自建有以肺癌早篩早診和治療為中心的動態大數據和人工智能平台。
自創立以來,基准醫療一直致力於自主開發有真正臨床價值的癌症早篩早診產品,產品管線覆蓋了包括肺癌、乳腺癌、消化道癌和泌尿系統癌在內的超過70%高發癌種的單癌種、多癌種和泛癌種早篩早診產品。
目前基准醫療已上市的兩款產品,肺結節良惡性診斷PulmoSeek(已升級為PulmoSeek Plus)與膀胱癌早檢UriFind,相關檢測技術均被國際重要醫學期刊收錄。未來,基准醫療將以持續創新為驅動力,開發更多國際領先早檢技術和產品,成為全球癌症早診早篩影響力企業。
更多產品信息與商務合作,歡迎撥打400-930-0052垂詢。