- 一項正在開展的sitravatinib聯合百澤安®的 1b 期臨床試驗數據顯示,該組合用藥針對PD-1/PD-L1 療法難治性或耐藥性的不可切除或轉移性黑色素瘤患者和鉑類耐葯卵巢癌患者具有初步抗腫瘤活性且總體耐受
美國麻省劍橋和中國北京2021年4月12日 /美通社/ -- 百濟神州(納斯達克代碼:BGNE;香港聯交所代碼: 06160),是一家處於商業階段的生物科技公司,專注於在全球範圍內開發和商業化創新藥物。公司今日 在美國癌症研究協會(AACR)2021 年年會上的兩項口頭報告中公佈了其抗 PD-1 抗體百澤安®(替雷利珠單抗)聯合與Mirati Therapeutics, Inc. 合作開發的在研選擇性激酶抑制劑 sitravatinib的臨床數據。在年會上公佈的數據來自一項1b期臨床試驗(NCT03666143)的兩個佇列,分別用於治療PD-1/PD-L1 療法難治性或耐藥性的不可切除或轉移性黑色素瘤患者以及用於治療晚期鉑類耐葯卵巢癌(PROC)患者。
百濟神州先前與Mirati Therapeutics, Inc. 達成獨家合作和授權協定,在亞洲(不包括日本)、澳大利亞和紐西蘭共同開發、生產和商業化sitravatinib。
百濟神州腫瘤免疫學首席醫學官賁勇醫學博士表示:「從今天公佈的數據來看,我們認為sitravatinib聯合百澤安®有望為晚期實體瘤患者提供臨床益處,並支持我們在正在開展的臨床試驗中進一步評估這項組合用藥。此外,我們很興奮地在PD-1/PD-L1 療法難治性或耐藥性黑色素瘤患者中觀察到了初步抗腫瘤活性。我們將繼續對患者進行隨訪並完成試驗的全部患者入組,也期待同時不斷加深對該組合用藥的認知,為世界各地的患者提供一款新型抗擊癌症的療法。」
這項開放性、多中心的1b 期臨床試驗旨在評估sitravatinib 聯合百澤安®針對晚期實體瘤患者的安全性/耐受性和初步抗腫瘤活性。試驗的主要終點為該項組合用藥的安全性/耐受性;關鍵次要終點包括經研究者基於實體瘤療效評價標準(RECIST 1.1) 評估的客觀緩解率(ORR)、疾病控制率(DCR)和無進展生存期(PFS)。此外,該試驗也對總生存期(OS)進行評估。
針對PD-1/PD-L1 抑制劑療法難治性或耐藥性的不可切除或轉移性黑色素瘤患者的試驗結果
北京腫瘤醫院崔傳亮教授表示:「免疫檢查點抑制劑的出現改變了針對晚期黑色素瘤的治療方法,但由於原發性或先天性耐葯,很大一部分患者無法從中獲益。在這項1b期臨床試驗中,我們很高興地看到sitravatinib 聯合百澤安®針對PD-1/L1耐藥性黑色素瘤患者總體耐受良好,並且展現了初步抗腫瘤活性,這一點十分令人鼓舞。」
截至數據截點2020年10月13日,共有25例先前PD-1/PD-L1 療法難治性或耐藥性且未接受過其他免疫療法的的不可切除或轉移性黑色素瘤患者入組1b期試驗G佇列,其中包括12例皮膚型、7例肢端型和4例黏膜型患者。截至數據截點,16例患者(64%)仍在接受研究治療。在中位隨訪時間為5.5月時,結果包括:
- 全部 25 例患者均經歷了至少一起任一級別的治療期間出現的不良事件(TEAE)。最常見(≥20%)的為谷丙轉氨酶(ALT)升高(76%)、谷草轉氨酶(AST)升高(68%)、膽固醇升高(56%)、血高甘油三酯升高(52%)、甲狀腺功能減退(48%)、體重減輕(48%)、血肌酸激酶升高(BCK; 40%)、腹瀉(40%)、γ-谷氨酰轉移酶升高(GGT; 40%)、蛋白尿(40%)、血膽紅素升高(BB; 36%)、心電圖T波異常(36%)、高血壓(36%)、掌趾紅斑感覺異常綜合症(32%)、肌酸激酶-心肌同工酶升高(CK-MB;28%),高尿酸血症(28%),上腹痛(24%)、嘔吐(24%)和低鉀血症(20%)
- 12例患者(48%)經歷了至少一起3級及以上的 TEAE,最常見(≥5%)為高血壓(12%)、ALT升高(8%)和GGT升高(8%)
- 1例患者(4%)經歷了肛門膿腫的嚴重TEAE,經認定與sitravatinib相關
- 2例患者(8%)由於 TEAE 中斷試驗治療;1例因陰道出血而終止百澤安®治療(與百澤安®無關),另1例由於 BCK 升高而終止sitravatinib治療(與sitravatinib有關)
- 分別有18例患者(72%)和13例患者(52%)經歷了sitravatinib劑量中斷或減少
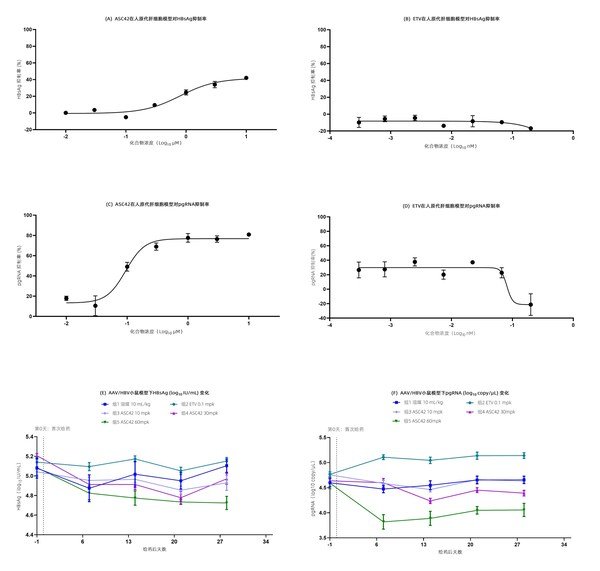
- 所有25例患者均納入有效性評估, 經確認的ORR 為24%(95% CI:9.4,45.1),其中6例患者達到了部分緩解(PR),DCR為88%(95% CI:68.8,97.5)
- 中位持續緩解時間(DoR)尚未達到,經研究者評估的中位PFS 為 6.7 個月(95% CI:4.07,未能評估)
針對晚期PROC患者的測試結果
澳大利亞 Icon 癌症中心內外全科醫學士Jeffrey Goh表示:「卵巢癌患者在接受當前標準治療后對鉑類療法產生耐藥性或難治性十分常見。 Sitravatinib 聯合百澤安®用於治療包括先前接受過多項療法的晚期PROC患者時,均體現了初步抗腫瘤活性且總體耐受良好。雖然目前患者樣本相對較小,但是我們期待這項全新的組合用藥在PROC中進一步評估。」
截至數據截點2020年10月13日,共有60例先前未接受過抗PD-1/PD-L1治療的復發性PROC患者入組了1b期試驗的E 佇列,其中13例(22%)仍在接受研究治療。這些患者先前接受過的中位治療線數為4(範圍:1,11)。在中位隨訪時間為6個月時,結果包括:
- 58例入組患者(97%)經歷了至少一起任一級別的TEAE。 最常見(≥20%)為腹瀉(67%)、噁心(57%)、疲勞(48%)、高血壓(40%)、食慾下降(37%)、嘔吐(37%)、腹痛(35%)、便秘(33%)、ALT升高( 30% )、尿路感染(27%),AST升高( 20%)、發聲困難(20%)、頭痛(20%)和掌趾紅斑感覺異常綜合症(20%)
- 41例患者(68%)經歷了至少一起3級及以上的 TEAE,最常見(≥5%)為高血壓(18%)和腹痛(12%)
- 42例患者(70%)經歷了至少1起嚴重TEAE
- 23例患者(38%)由於 TEAE 中斷試驗治療,其中9例(15%)中斷百澤安®治療、14例(23%)中斷sitravatinib治療
- 分別有50例患者(83%)和30例患者(50%)經歷了sitravatinib劑量中斷或減少
- 4例患者由於 TEAE 死亡,均認定與試驗治療無關
- 在納入有效性評估的53例患者中,經確認的ORR 為26%(95% CI:15.3,40.3),其中14例患者達到了PR,DCR為77%(95% CI:63.8,87.7)
- 中位DoR 為 4.7 個月(95% CI:2.8,未能評估)
- 中位PFS和OS分別為 4.1個月(95% CI:4.0,5.1)和12.9 個月(95% CI:6.3,17.2)
關於 Sitravatinib
Sitravatinib 是一款在研多靶點受體酪氨酸激酶(RTK)抑制劑,可潛在刺激機體免疫反應以抵抗癌症。 Sitravatinib抑制VEGFR和TAM(TYRO3、AXL、MERTK)受體家族,這些家族與協調免疫抑制性腫瘤微環境(TME)有關。已顯示抑制這些受體可刺激抗腫瘤免疫反應,並有可能使先前對CPI治療產生抗藥性的患者重新對CPI治療敏感。Sitravatinib通過抑制特定的RTK使免疫抑制性TME轉化為免疫支援性TME,與CPI治療聯合有可能重獲免疫應答以克服CPI治療的耐藥性。多項評估Sitravatinib用於治療CPI耐葯的晚期非小細胞肺癌患者和特定的未接受過CPI治療的患者的臨床試驗(包括3期SAPPHIRE試驗)正在進行中。
更多信息請訪問:www.mirati.com/science
關於百澤安®(替雷利珠單抗注射液)
百澤安®(替雷利珠單抗注射液)是一款人源化 lgG4 抗程式性死亡受體 1(PD-1)單克隆抗體,設計目的是為最大限度地減少與巨噬細胞中的 Fcγ 受體結合。臨床前數據表明,巨噬細胞中的 Fcγ 受體結合之後會啟動抗體依賴細胞介導殺傷 T 細胞,從而降低了 PD-1 抗體的抗腫瘤活性。百澤安®是第一款由百濟神州的免疫腫瘤生物平台研發的藥物,目前正進行單葯及聯合療法臨床試驗,開發一系列針對實體瘤和血液腫瘤的廣泛適應症。
百澤安®已在中國獲批聯合化療用於治療一線晚期鱗狀非小細胞肺癌(NSCLC)患者。百澤安®另獲附條件批准用於治療至少經過二線系統化療的復發或難治性經典型霍奇金淋巴瘤(cHL)患者以及 PD-L1 高表達的含鉑化療失敗包括新輔助或輔助化療 12 個月內進展的局部晚期或轉移性尿路上皮癌(UC)患者。針對上述兩項適應症的完全批准將取決於正在進行的確證性隨機對照臨床試驗結果。
此外,三項百澤安®新適應症上市申請在中國已獲受理且正在審評過程中,包括一項聯合化療用於治療一線晚期非鱗狀 NSCLC 患者、一項用於治療既往接受鉑類化療后出現疾病進展的二或三線局部晚期或轉移性NSCLC患者,以及一項用於治療既往經治的不可切除肝細胞癌患者。
目前共有 16 項百澤安®的註冊性臨床試驗在中國和全球範圍內開展,其中包括 13 項 3 期臨床試驗和3 項關鍵性 2 期臨床試驗。
2021年1月,百濟神州與諾華達成合作協定,授權諾華在北美、歐洲和日本開發、制造和商業化百澤安®。
百澤安®在中國以外國家地區尚未獲批。
關於百澤安®(替雷利珠單抗注射液)的臨床項目
替雷利珠單抗的臨床試驗包括:
- 替雷利珠單抗對比多西他賽用於二線或三線治療非小細胞肺癌患者安全性有效性的3期臨床試驗(clinicaltrials.gov 登記號:NCT03358875)
- 替雷利珠單抗對比救援性化療用於治療復發或難治性經典型霍奇金淋巴瘤患者的3期臨床試驗(clinicaltrials.gov 登記號:NCT04486391)
- 替雷利珠單抗用於治療局部晚期或轉移性尿路上皮癌患者的3期臨床試驗(clinicaltrials.gov 登記號:NCT03967977)
- 替雷利珠單抗聯合化療對比化療用於一線治療晚期鱗狀非小細胞肺癌患者的3期臨床試驗 (clinicaltrials.gov 登記號:NCT03594747)
- 替雷利珠單抗聯合化療對比化療用於一線治療晚期非鱗狀非小細胞肺癌患者的3期臨床試驗(clinicaltrials.gov登記號:NCT03663205)
- 替雷利珠單抗聯合含鉑雙藥化療用於治療非小細胞肺癌患者的3期臨床試驗(clinicaltrials.gov登記號:NCT04379635)
- 替雷利珠單抗/安慰劑聯合鉑類藥物和依託泊苷用於治療廣泛期小細胞肺癌患者的3期臨床試驗(clinicaltrials.gov 登記號:NCT04005716)
- 替雷利珠單抗對比索拉非尼用於一線治療肝細胞癌患者的3期臨床試驗(clinicaltrials.gov 登記號:NCT03412773)
- 替雷利珠單抗用於治療不可切除的肝細胞癌經治患者的2期臨床試驗(clinicaltrials.gov 登記號:NCT03419897)
- 替雷利珠單抗用於治療局部晚期或轉移性尿路上皮膀胱癌患者的2期臨床試驗(clinicaltrials.gov登記號:NCT04004221)
- 替雷利珠單抗對比化療用於二線治療食管鱗狀細胞癌患者的3期臨床試驗(clinicaltrials.gov登記號:NCT03430843)
- 替雷利珠單抗聯合化療用於一線治療食管鱗狀細胞癌患者的3期臨床試驗(clinicaltrials.gov登記號:NCT03783442)
- 替雷利珠單抗對比安慰劑聯合同步放化療用於治療局限性食管鱗狀細胞癌患者的3期臨床試驗(clinicaltrials.gov登記號:NCT03957590)
- 替雷利珠單抗聯合化療對比安慰劑聯合化療用於一線治療胃癌的3期臨床試驗(clinicaltrials.gov登記號:NCT03777657)
- 替雷利珠單抗用於治療MSI-H或dMMR實體瘤患者中的2期臨床試驗(clinicaltrials.gov登記號:NCT03736889)
- 替雷利珠單抗聯合化療對比安慰劑聯合化療用於一線治療鼻咽癌患者的3期臨床試驗(clinicaltrials.gov登記號:NCT03924986)
關於百濟神州
百濟神州是一家全球性、商業階段的生物科技公司,專注於研究、開發、生產以及商業化創新性藥物以為 全世界患者提高療效和藥品可及性。百濟神州目前在全球擁有 5400 多名員工,正在加速推動公司多元化的新型癌症療法藥物管線。目前,百濟神州兩款自主研發的藥物,BTK 抑制劑百悅澤®(澤布替尼膠囊)正在 美國和中國進行銷售、抗 PD-1 抗體藥物百澤安®(替雷利珠單抗注射液)在中國進行銷售。此外,百濟神州在中國正在或計劃銷售多款由安進公司、新基物流有限公司(隸屬百時美施貴寶公司)以及 EUSA Pharma 授權的腫瘤藥物,並與諾華達成合作協議,授權諾華在北美、歐洲和日本開發、生產和商業化抗 PD-1 抗體百澤安®。欲瞭解更多信息,請訪問 www.beigene.com.cn。
前瞻性聲明
該新聞稿包含根據《1995年私人證券訴訟改革法案》(Private Securities Litigation Reform Act of 1995)以及其他聯邦證券法律下定義的前瞻性聲明,包括sitravatinib 聯合百澤安®的1b期臨床試驗數據及未來可能被證實的臨床益處,在「關於sitravatinib」標題下有關sitravatinib的聲明,以及有關百濟神州與百澤安 ®和 sitravatinib 相關的進展計畫、預期的臨床開發計畫、藥政註冊里程碑及商業化等。由於各種重要因素的影響,實際結果可能與前瞻性聲明有重大差異。這些因素包括了以下事項的風險:百濟神州證明其候選藥物功效和安全性的能力;候選藥物的臨床結果可能不支援進一步開發或上市審批;藥政部門的行動可能會影響到臨床試驗的啟動、時程表和進展以及藥物上市審批;百濟神州的上市藥物及藥物候選物(如能獲批)獲得商業成功的能力;百濟神州獲得和維護對其藥物和技術的智慧財產權保護的能力;百濟神州依賴第三方進行藥物開發、生產和其他服務的情況;百濟神州取得監管審批和商業化醫藥產品的有限經驗,及其獲得進一步的營運資金以完成候選藥物開發和實現並保持盈利的能力;新冠肺炎全球大流行對百濟神州的臨床開發、監管、商業化運營、監管以及其他業務帶來的影響;百濟神州在最近年度報告10-K 表格中「風險因素」章節里更全面討論的各類風險;以及百濟神州向美國證券交易委員會期后呈報中關於潛在風險、不確定性以及其他重要因素的討論。本新聞稿中的所有信息僅及於新聞稿發佈之日,除非法律要求,百濟神州並無責任更新該些信息。